Bonjour
Je voulais consacrer un article à la lessive...les pourquoi du comment ? Mais la lessive sans eau, n'a aucune action (nous verrons pourquoi d'ailleurs)...alors commençons par la première étape, par une petite mise en lumière sur l'eau.

L'eau est un composé chimique simple, si présente autour de nous (70% de la surface de la terre) , si utile à la vie, qu'on en oublie toutes ses particularités...c'est un sujet passionnant et ses caractéristiques permettent de comprendre bien des phénomènes de notre vie quotidienne.
Présentation générale
L'eau est un molécule constituée de deux atomes d'hydrogène et d'un atome d'oxygène , ce qui s'écrit H2O... c'est donc assez simple (jusque là ! mais nous verrons que cela lui confère certaines propriétés particulières).
Maintenant regardons d'un peu plus près, ses propriétés macroscopiques !
A quelle température l'eau bout-elle ? A 100 °C, répondons nous en coeur ! et bien, tout dépend.
L'eau d'une casserole bout effectivement à 100 °C lorsque la pression qui s'exerce sur elle est bien la pression atmosphérique de 101 325 Pa ou 1013 mbar.
Mais dans une cocotte minute par exemple, la pression est plus élevée, l'eau y bout au-delà de 100 °C (120 à 130 °C selon la cocotte)...L'eau dans une casserole en montagne où la pression est inférieure à la pression atmosphérique au niveau de la mer, bout dès 90°C vers 3000 m (pas suffisant pour cuire les oeufs durs).
J'ouvre ici une petit parenthèse pour vous donner une vision (c'est celle que j'ai adoptée) des choses de ce que sont les grandeurs comme pression, température et chaleur.
Pression - Température - Chaleur
La pression est la poids de ce qui s'exerce au dessus d'une surface. La pression atmosphérique est la poids de la colonne d'air au-dessus de nos têtes.
Dans les fonds marins, la pression est énorme car il faut en plus du poids de l'air, supporter le poids de l'eau.
La température est une mesure du degré d'agitation des différents constituants élémentaires d'un corps. Plus ce corps est chaud, plus l'agitation et la vitesse à laquelle les molécules se meuvent est élevée. On appelle cela l'énergie cinétique (énergie liée à la vitesse). La température est une mesure du mouvement moyen à l'échelle moléculaire.

Et la chaleur alors ? La chaleur est la quantité d'énergie (énergie cinétique mais aussi énergie liée à la rotation, vibration) d'un système transferée selon trois principes : conduction, convection, rayonnement (nous reveroons en détail et à l'aide d'expemple ces trois modes de transfert de la chaleur).
Ainsi, on comprend aisément que lorsqu'on chauffe un corps, on lui apporte de l'énergie. Au niveau moléculaire, cela se peut se traduire par :
- une agitation plus importante : d'où l'augmentation de la température (casserole d'eau qui chauffe par exemple)
- un changement d'état : les particules acquièrent plus d'énergie, bougent plus rapidement (c'est l'augmentation de température dans une première étape) et subissent nécessairement plus de collisions. Il en resulte qu'elles ont tendance à occuper plus d'espace, certaines ont assez d'énergie pour quitter la surface du liquide et passer à l'état gazeux (c'est l'eau qui bout dans la casserole). Notons que pendant toute l'étape de changement d'état, toute la chaleur fournie est uniquement utilisée pour briser les liaisons qui retiennent les molécules les unes aux autres et permettre à ces molécules de s'échapper en phase vapeur : il n'y a donc plus d'augmentation de la température pendant le changement d'état.

Avec ces visualisations de pression, température et chaleur, il est facile de comprendre ce qui se passe au sein d'une cocotte minute. L'eau de la cocotte chauffe jusqu'à atteindre 100 °C (au départ on est bien sous pression atmosphérique), c'est-à-dire que les molécules se sont agitées de plus en plus jusqu"à obtenir suffisamment d'énergie pour quitter le liquide et pouvoir passer en phase vapeur...de plus en plus de monde quitte l'état liquide et passe en phase vapeur pour occuper un volume plus grand...oui mais le couvercle est hermétiquement fermé : le volume qu’occupe la vapeur étant beaucoup plus grand que celui occupé par une même quantité de liquide (rapport d’environ 1000), la vapeur formée « manque d’espace » : la pression augmente.
Comme la pression augmente, les molécules d'eau restant dans le liquide ont plus de difficulté à s'échapper : c'est lourd au-dessus de leur tête, il faut davantage s'agiter : la température augmente donc au-delà de 100 °C.
La cuisson des aliments s'en trouve accélérée lorsque la température est proche de 120 °C.
Revenons aux particularités de l'eau
Comme précisé en début d'article, la molécule d'eau est assez petite et assez simple. Mais regardons le cas de l'ammoniac (NH3) et du méthane (CH4) qui sont des molécules de masse voisine de celle de l'eau, et qui ont un point d'ébullition de -33 et -161 °C. Si l'eau se comportait normalement, elle devrait être gazeuse comme les autres corps à la pression atmosphérique...ce qui fort heureusement pour nous, n'est pas le cas.
Le pourquoi de cette originalité vient du fait que les molécules d'eau sont liées entre elles par des intéractions très importantes, qu'on appelle "liaisons hydrogène" ou "pont hydrogène". Comme le montre la figure ci-dessous qui schématise une molécule d'eau, celle-ci est polaire : il y a un côté chargé négativement et l'autre positivement. Cette différence de charge fait que les molécules s'attirent les unes les autres, et des liens se créent.


A l'état liquide, les liaisons Hydrogène sont présentes mais l'agitation gêne un peu leur mise en place. Lorsqu'on refroidit l'eau, l'agitation des molécules ralentit de plus en plus ce qui permet aux liaisons hydrogène de bien s'établir : l'eau solide (la glace) a la structure d'un réseau cristallin où les liaisons H maintiennent une certaine distance entre les molécules : ce n'est donc pas la structure la plus compacte possible.

Structure de l'eau liquide : Oxygène en rouge, Hydrogène en blanc et liaisons H en pointillés
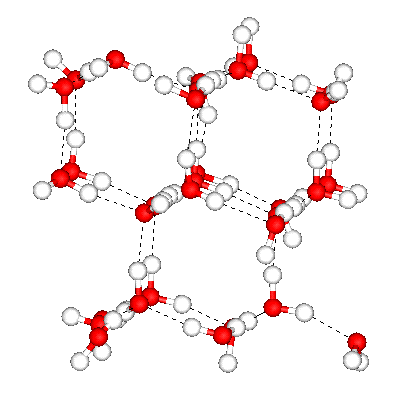
Une des structure cristalline possible de la glace : les liaisons H maintiennent de la distance entre les molécules
La conséquence de cet arrangement est que l'eau liquide est plus dense que la glace ou encore le volume de la glace est plus grand que celui du liquide (les pots qui gèlent éclatent !) (pour les autres corps où la liaison hydrogène n'existe pas, c'est le contraire).
C'est la raison pour laquelle la glace flotte sur l'eau (les icebergs !). Important aussi pour la survie des espèces aquatiques : la glace qui se forme à la surface d'un étang flotte ce qui permet de protéger les profondeurs du gel.

Source : clic clic
On se quitte avec une petite photo d'un flocon de neige...la géométrie s'explique aussi par ces liaisons H (symétrie hexagonale qui apparait bien dans le schéma de la structure moléculaire ci-dessus), nous y reviendrons si cela vous intéresse !

Source : clic clic
Bonne lecture et à une prochaine fois !
Pour en savoir plus
http://www.educonline.net/spip/spip.php?article49
http://www.pourquois.com/physique_chimie.html
http://www.dossiersdunet.com/rubrique48.html